Laboratorio di Biomorfologie
Responsabile del Laboratorio: Prof. Alessio Papini
E-mail: alessio.papini@unifi.it
Numero Telefonico: 055 2757399
Referenti Scientifici: Silvia Schiff, Giovanni Stefano, Alessio Papini
Tecnici: Pietro Di Falco, Corrado Tani
Collaboratori: Sara Falsini
Dottorandi: Emilio Corti
DESCRIZIONE ATTIVITÀ
L’attività principale del laboratorio è centrata sulle attività di Microscopia Ottica, a fluorescenza, confocale ed elettronica, sia a scansione che a trasmissione.
Altri punti di interesse del laboratorio sono la coltivazione e la biologia di alghe unicellulari e macroalghe e lo studio di piante farmaceutiche, in particolare tropicali, in collaborazione con il Centro Studi Erbario Tropicale. Altro focus sulla patologia di specie vegetali, in particolare specie coltivate.
Alessio Papini e Giovanni Stefano si occupano in particolare di biologia cellulare, con particolare riferimento a endomembrane, autofagia e morte cellulare programmata.
Silvia Schiff in particolare di studi microscopici su patologie di piante coltivate.
Sara Falsini si occupa di interazione di nanoparticelle con le piante.
Emilio Corti svolge la sua attività principale sullo stress salino su piante delle Brassicaceae.
In collaborazione principalmente con la Sezione di Patologia Vegetale del Dipartimento di Scienze e Tecnologie Agrarie, Alimentari, Ambientali e Forestali (Prof. Guido Marchi) (Scuola di Agraria di Firenze), la nostra attività di ricerca riguarda l’indagine di microscopia ottica (LM) ed elettronica (SEM) sull’anatomia di specie vegetali soggette a infezione naturale da Xylella fastidiosa subsp. multiplex ST 87 in Toscana.
Le osservazioni condotte dal personale del Laboratorio particolarmente esperto nel settore, documentano la presenza e le modalità di colonizzazione del batterio all’interno del singolo elemento cellulare fino alla sua completa occlusione e diffusione, sia in senso longitudinale che trasversale, agli altri elementi adiacenti del tessuto vascolare in piante di Spartium junceum L. (Ginestra comune o Ginestra odorosa) presenti a Monte Argentario in Toscana. L’utilizzo delle diverse tecniche e metodologie di colorazione utilizzate nel nostro Laboratorio, evidenzia inoltre la strategia di reazione e meccanismo di difesa della pianta nei confronti del patogeno attraverso la produzione di barriere fisiologiche e chimiche quali la sintesi di gomme e gel.
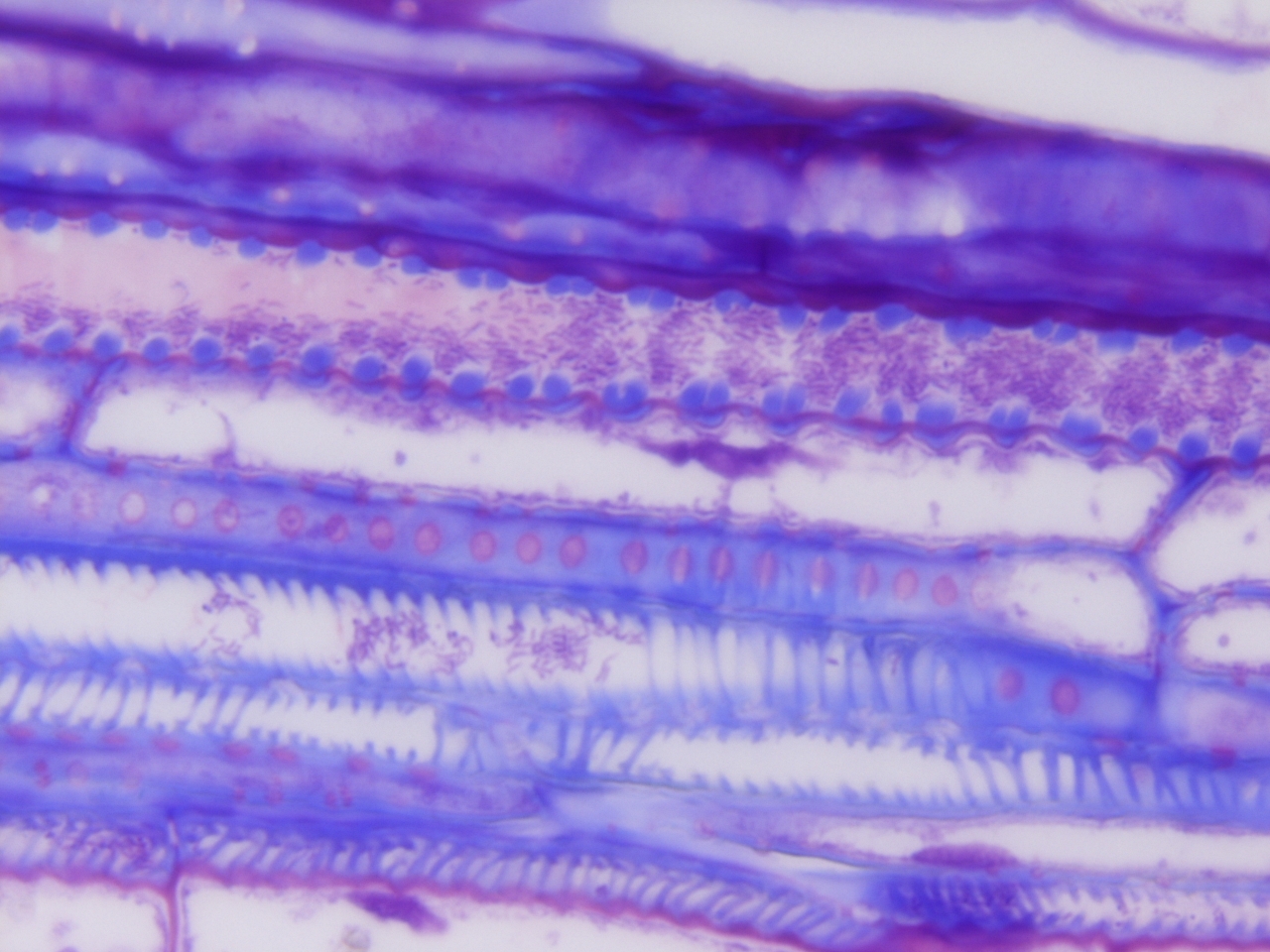
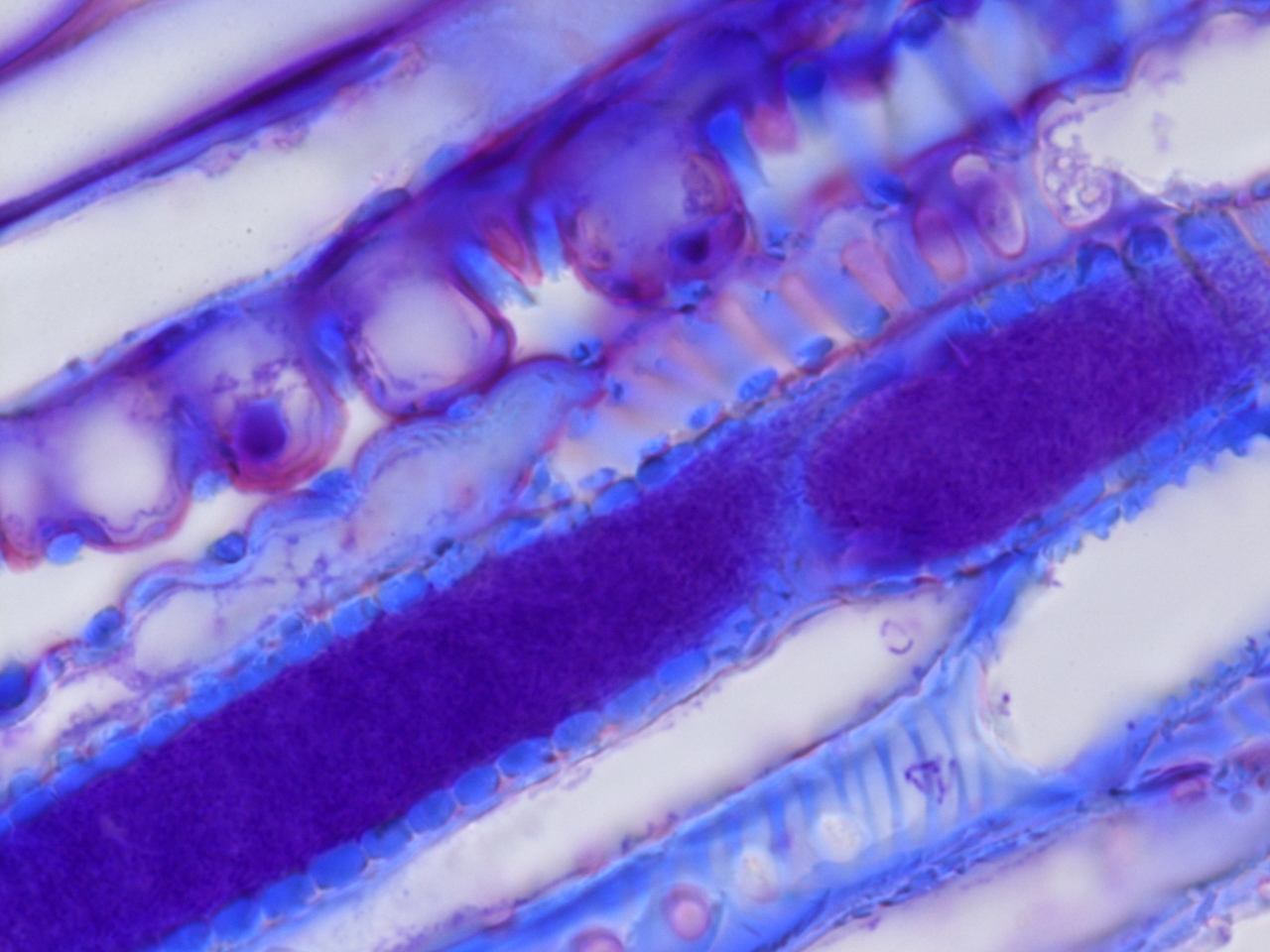
Altra collaborazione sempre con la Sezione di Patologia Vegetale del Dipartimento di Scienze e Tecnologie Agrarie, Alimentari, Ambientali e Forestali (Prof.ssa Laura Mugnai) (Scuola di Agraria di Firenze) riguarda l’indagine di microscopia ottica sulle varie tecniche di innesto adottate nella Vite (Vitis vinifera L.). Le tecniche dell’innesto, che hanno una storia millenaria nel settore sia orticolo che arboreo produttivo e ornamentale, sono di basilare importanza nel settore viticolo in quanto hanno permesso il superamento del problema della Fillossera (Daktulosphaira vitifoliae Fitch 1855), patogeno segnalato nell’800 e responsabile della morte dei vitigni europei. Solo infatti con l’innesto delle nostre varietà di Vite su un portainnesto di origine americana, risultato resistente al patogeno, è stato possibile ripristinare una moderna viticoltura.
La nostra indagine segue la riuscita e funzionalità dell’innesto, ossia del contatto del “nesto” rappresentato dalle diverse varietà dei vitigni (Teroldego, Cabernet Sauvignon e Glera) con il “portainnesto” americano, dal momento della sua realizzazione ad oltre i 3-4 mesi di vita delle piante in vivaio per tre tipi diversi di innesto: “Doppio spacco”, “Omega” e “V” adottati. Osservazioni condotte allo Stereomicroscopio poi approfondite al Microscopio Ottico, documentano la reattività dei vari tessuti coinvolti sia del nesto che portainnesto e ne seguono l’evoluzione fino alla riuscita, o meno, del ripristino di un collegamento vascolare tra i due bionti.



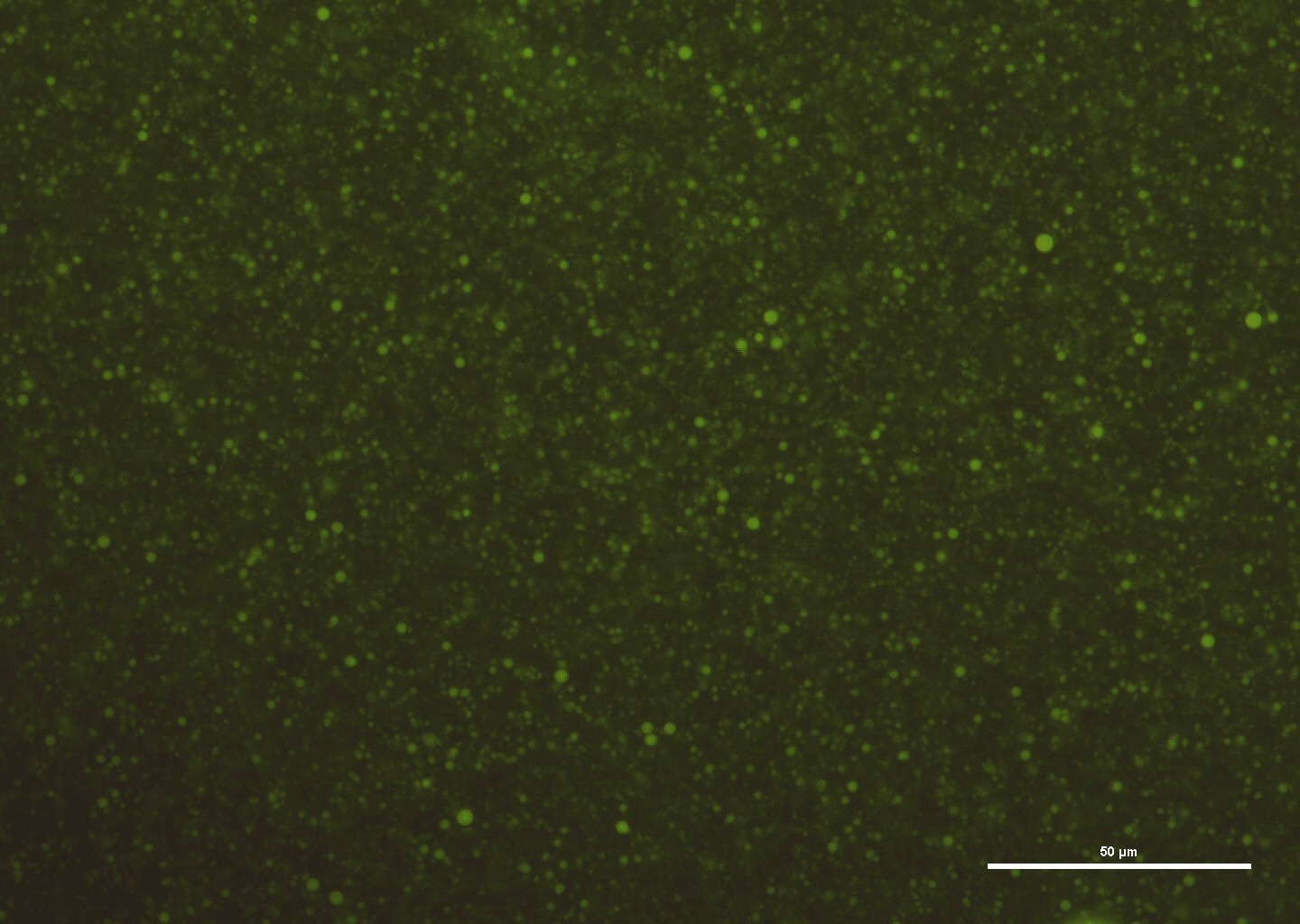
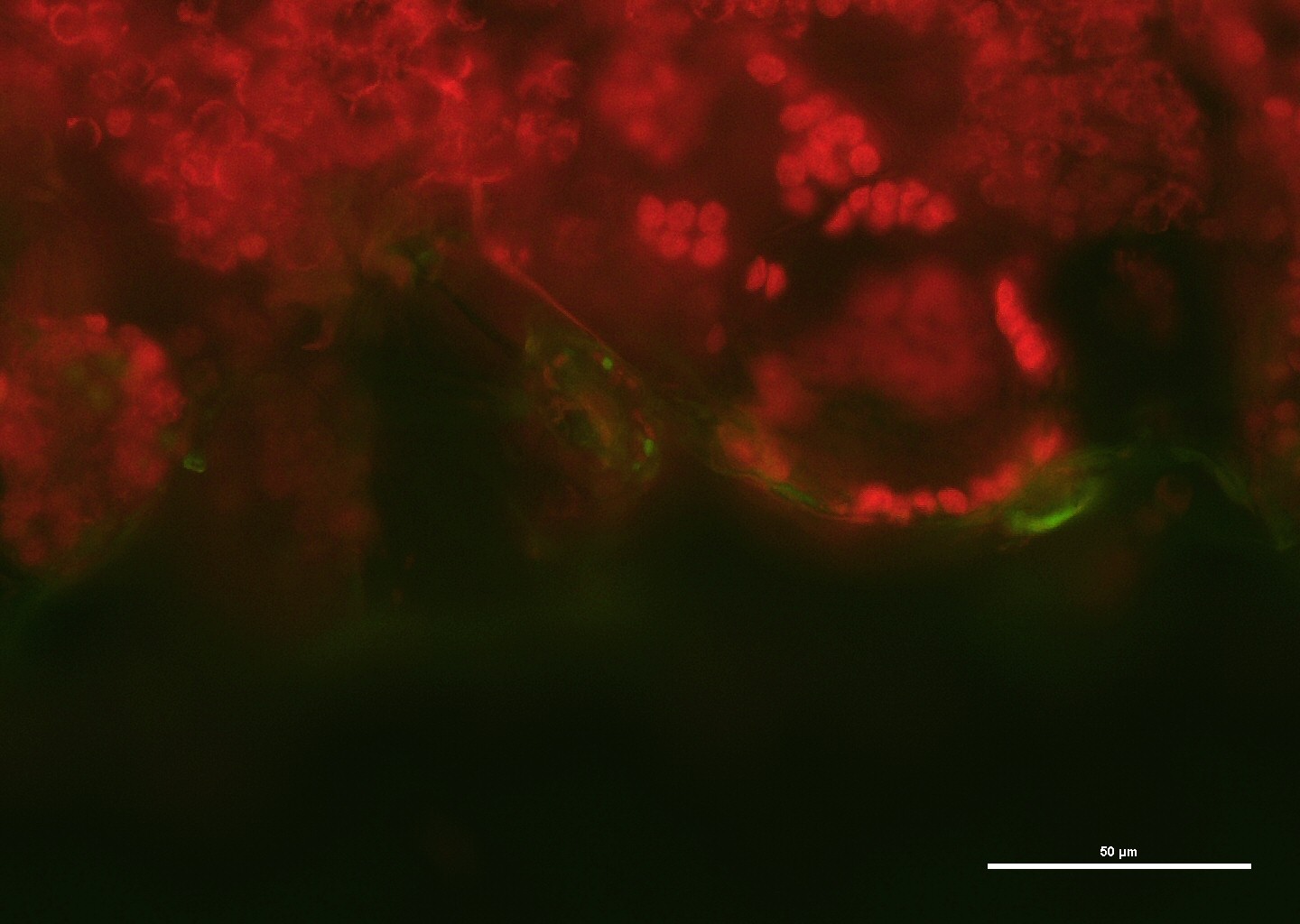
In collaborazione con il Dipartimento di Chimica (Prof.ssa Sandra Ristori) e con il Laboratorio di Fisiologia Vegetale (Prof. ssa Cristina Gonnelli e Prof.ssa Ilaria Colzi), la nostra attività di ricerca consiste nella messa a punto di nuovi nanosistemi eco-compatibili. Infatti è sempre più urgente nella produzione di nanosistemi, l’individuazione di approcci più sostenibili come ad esempio materiali di partenza rinnovabili, solventi meno tossici e componenti biodegradabili. Queste procedure sono importanti specialmente quando le nanoparticelle passano, dallo studio in laboratorio, alla produzione su larga scala. Nel nostro caso abbiamo studiato un sistema di trasporto a base di lignina, un polimero biodegradabile e rinnovabile che costituisce un’alternativa biocompatibile ai polimeri convenzionali per veicolare molecole bioattive in specie importanti dal punto di vista commerciale (rucola, tef, pomodoro etc.). A questa attività si aggiunge lo studio dell’uptake dei nanoaggregati, mediante un tracciante fluorescente all’interno dei tessuti della pianta, nel caso in cui vengano assorbite a livello radicale o fornite sotto forma di spray fogliare.
ATTREZZATURE
- Agitatore orizzontale ASAL 709/O
- Bagnomaria termo statizzato
- Bilancia analitica METTLER AE 260-S
- Bilancia analitica METTLER H35 AR
- Bilancia tecnica elettronica GIBERTINI
- Bollitore Falc
- Camera digitale NIKON DS-5M
- Centrifuga da tavolo
- Criostato AMERICAN OPTICAL CRYO-CUT
- Essiccatore per negativi
- Evaporatore rotante RE-111/
- Fibre ottiche per luce riflessa KL1500 SCHOTT
- Microscopio elettronico a trasmissione EM300
- Microscopio elettronico Philips EM 201
- Microscopio ottico BIOVAR-129 ORIG. REICHERT
- Microscopio ottico LEITZ DM-RB FLUO a luce bianca e fluorescenza
- Microtomo rotativo AUTOCUT UNIVERSALE
- Phmetro MICROPH 2000
- Phmetro METTLER Toledo
- Piastra riscaldante con agitatore magnetico
- Stereo microscopio NIXON SMZ 1,
- Stereoscopio con gruppo fotografico ZEISS
- Stereoscopio grandangolare per luce riflessa e trasmessa WILD M5
- Stufa a tenuta a vuoto VO/E
- Stufa incubatore TAAB M30
- Taglia lame HISTOKNIFEMAKER ORIG. JUNG
- Ultramicrotomo REICHERT OM U3
- Ultramicrotomo ULTRA REICHERT JUNG ULTRACUT E
- Vibratomo 1000 plus (in comodato d’uso DAGRI)
- Videocamera OPTIKA MICROSCOPES
Ultimo aggiornamento
13.02.2026
